临床生物化学与分子生物学教研室目前总共承担国家自然科学基金项目14项,在研项目4项,省部级课题20余项,近3年发表专业论文40余篇,其中SCI收录文章近20篇。主要研究方向包括肿瘤的细胞免疫、肿瘤的分子基础及临床相关研究。逐步形成了稳定的科研方向及由教研室老师带领本、硕、博学生组成的科研团队。
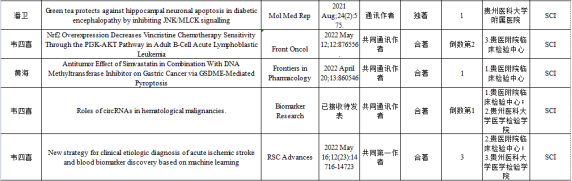
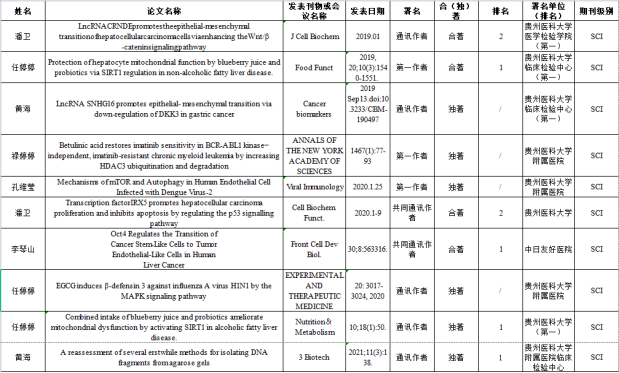
临床生物化学与分子生物学教研室近三年发表SCI一览表 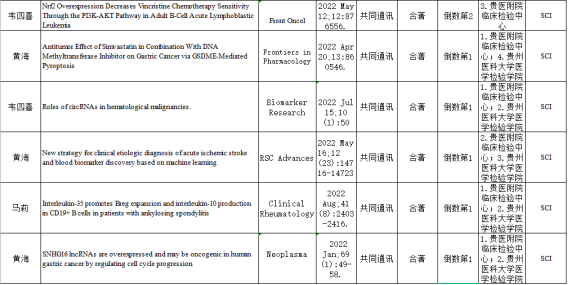
临床生物化学与分子生物学教研室在研项目一览表 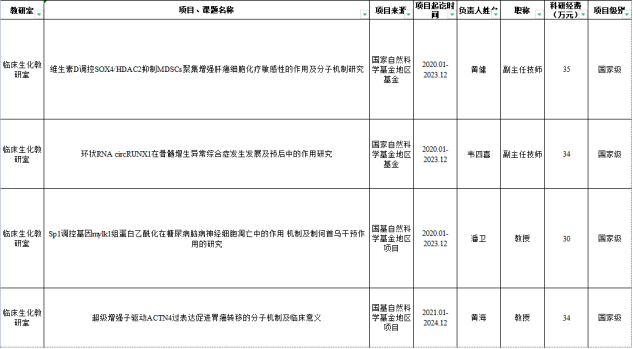

科研发现 黄海教授团队联合兰州大学第一附属医院前沿创新研究中心金卫林教授及上海交通大学纳米生物医学与工程研究所宋存峰研究员在Frontiers in pharmacology(IF:5.81;JCR Q1;中科院二区)期刊上发表了他汀在胃癌抗肿瘤研究方面的新成果,题目为“Antitumor Effect of Simvastatin in Combination With DNA Methyltransferase Inhibitor on Gastric Cancer via GSDME-Mediated Pyroptosis ” [1]。必赢线路检测30032019级博士研究生夏英和2019级硕士研究生金泳为论文共同第一作者,该研究在细胞和动物模型中展现了他汀药物联合DNA甲基转移酶抑制剂在胃癌治疗中的巨大潜力,证明caspase-3/GSDME在辛伐他汀触发细胞焦亡过程中是必需的。结论提示,重新激活GSDME的表达,从而诱导癌细胞特异性焦亡是一种潜在的胃癌治疗策略。 
Gasdermin E (GSDME)是细胞程序性裂解死亡的执行者之一,可刺激下游caspase-3活化而触发。启动子高甲基化导致GSDME表达沉默与胃癌有关,本研究通过对胃癌细胞系和临床样本的生物信息学分析和甲基化特异性PCR (MSP)检测证实了这一点。GC细胞系和小鼠异种移植模型研究了常见的胆固醇消耗药物辛伐他汀(SIM)的致焦亡作用,并通过多西环素(DOX)诱导的Tet-on系统或DNA甲基转移酶抑制剂5-Aza-2'-脱氧胞苷(5-Aza-CdR)上调GSDME的表达。细胞活力评估和异种移植肿瘤生长表明,提高GSDME的表达可增强SIM的肿瘤抑制作用。通过对乳酸脱氢酶(LDH)释放和caspase-3/GSDME蛋白裂解的形态学检测和分析,证实了焦亡的刺激是一个重要的机制。利用短发夹RNA (shRNA)敲除caspase-3或GSDME,以及caspase-3特异性抑制剂,提供了caspase-3/GSDME在SIM触发的焦亡过程中需要的证据。该研究的结论提示,重新激活GSDME表达从而诱导癌细胞特异性的坏死可能是一种潜在的治疗GC的策略。 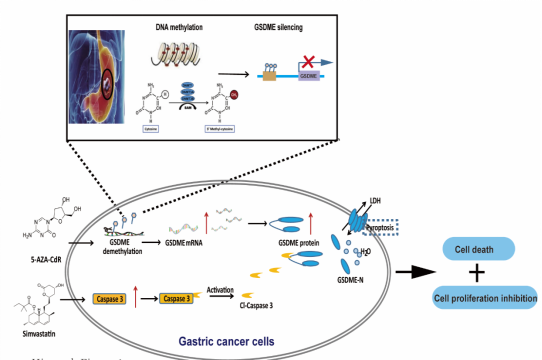
5-Aza-CdR通过caspase-3/GSDME途径促进辛伐他汀诱导的胃癌细胞焦亡。 本研究中注意到辛伐他汀增加了MGC-803细胞和异种移植物中GSDME基因的转录,但其机制未能进一步探索。有趣的是,他汀类药物被认为是DNA甲基转移酶(DNMT)抑制剂,通过抑制DNMT调控结直肠癌细胞和异种移植小鼠中如BMP2启动子高甲基化而使基因沉默[2]。作者推测在该研究模型中具有类似的表观遗传机制。但是,具体深入的调控机制和蛋白互作,有待后续进一步的研究。
|